

上海有机所在原癌基因MYC的小分子抑制剂研发方面取得进展
癌基因MYC在细胞增殖、代谢和分化等多种生物学过程中发挥关键作用,同时也是人类肿瘤中最常被激活的癌基因之一。长期以来,MYC被认为是一个极具潜力但充满挑战的治疗靶点。尽管抑制MYC的策略已取得重要进展,目前尚未有针对MYC驱动肿瘤的有效靶向药物问世。其主要原因在于MYC蛋白缺乏传统意义上的小分子结合口袋,难以通过直接抑制实现药物设计。在多数人类癌症中,MYC的失调并非源自基因突变,而是受上游致癌信号通路激活所致。靶向MYC启动子区域 G-四链体结构,借助基因沉默下调MYC的转录与表达,被认为是一种前景广阔的治疗策略。
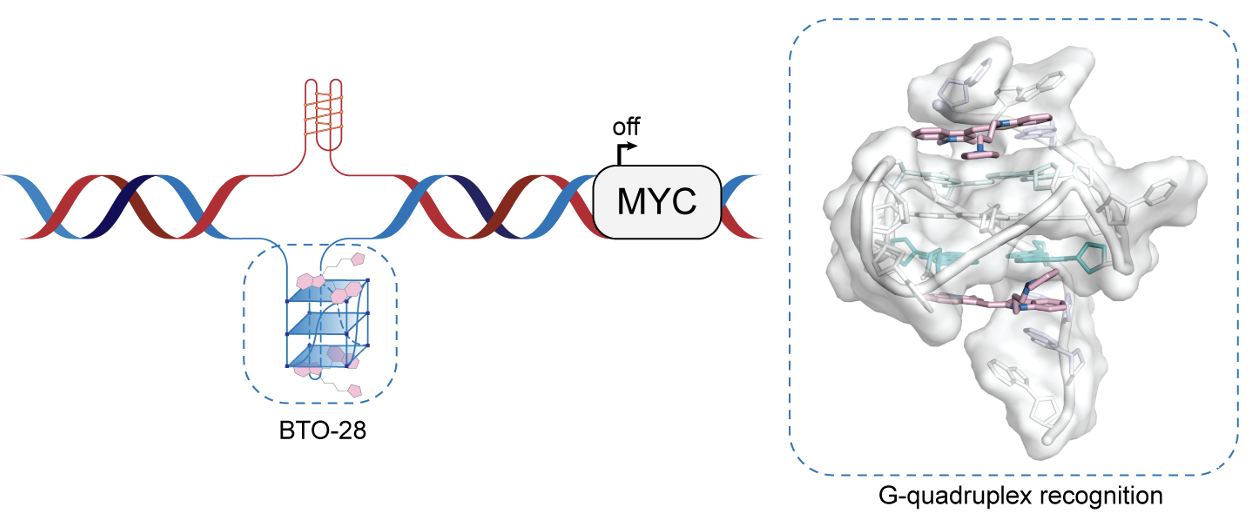
在这一背景下,中国科学院上海有机化学研究所曹春阳团队成功开发了一种新型苯并噻唑衍生物BTO-28,能够有效抑制MYC表达。机制研究显示,BTO-28通过π–π堆积与外部G-四链体结合,并与5′和3′-端灵活的侧翼碱基相互作用,调整构象以维持稳定的结合。BTO-28可在体外及细胞内诱导并稳定MYC G-四链体,在基因组水平选择性抑制MYC的转录活性,同时抑制转录因子SP1与RNA聚合酶II在MYC启动子区域的结合。本研究首次报道了核酸碱基替代物与侧翼碱基之间的独特氢键模式,为理解配体诱导的G-四链体结构变化如何调控复杂的转录过程提供了新的见解,也为针对MYC驱动的肿瘤开发新型靶向治疗药物提供了重要参考。相关成果以“Molecular Recognition and Effects of a Benzothiazole Derivative Targeting the MYC G-quadruplex”为题发表在Nucleic Acids Research杂志上(Nucleic Acids Res, 2025, 53(17), gkaf888, DOI:10.1093/nar/gkaf888)。
上海有机所博士倪啸为该论文的第一作者。曹春阳研究员与香港理工大学黄永樑教授为该论文的共同通讯作者,该研究得到了国家自然科学基金委,中国科学院先导项目以及香港研究资助局等资助。
附件下载:

