

上海有机所在发展高效唾液酸化抑制剂激活肿瘤免疫方向取得进展
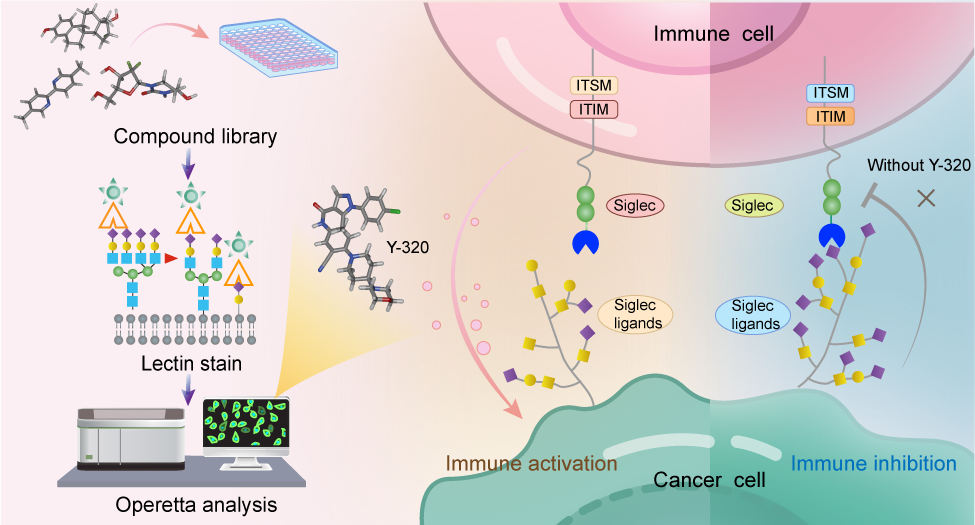
高度唾液酸化是肿瘤细胞的特征标志之一,在癌症进展中发挥关键作用。尤其是,肿瘤细胞表面唾液酸通过与免疫细胞表面的Siglec受体结合,抑制免疫应答,从而促进免疫逃逸。因此,干预唾液酸化过程被认为是开发新型癌症治疗策略的重要方向。目前,针对唾液酸化的大分子干预手段已取得一定进展,但小分子抑制剂的研发仍面临挑战。
近日,中国科学院上海有机化学研究所生命过程小分子调控全国重点实验室俞飚院士团队和合作者报道了一个迄今最高效的唾液酸化小分子抑制剂,并显示显著的免疫微环境激活及抗肿瘤效果。
该研究以具有典型高度唾液酸化表型的胰腺导管腺癌(PDAC)为模型,建立了高效的通量筛选平台,并以此筛选到可显著降低肿瘤细胞表面唾液酸化水平的小分子化合物Y-320。进一步的实验表明,Y-320能够广泛抑制肿瘤细胞表面α-2,3/2,6唾液酸化修饰,其半抑制浓度(IC50)达到约200 nM,是经典的泛唾液酸化抑制剂P-3Fax-Neu5Ac的300多倍。分子对接分析显示,Y-320很可能通过竞争性占据多种唾液酸转移酶的底物结合口袋而发挥抑制作用。
在多种体内模型中,Y-320表现出显著的肿瘤生长抑制能力,并可重塑肿瘤免疫微环境。免疫细胞分析揭示,Y-320的抗肿瘤效果依赖于CD8⁺ T细胞与巨噬细胞的协同作用。进一步的动物实验显示,Y-320与PD-1抗体联合应用能够起到优异的协同治疗效果;其抑瘤效果明显优于单一疗法,表明Y-320可有效逆转PDAC对免疫检查点阻断治疗的耐药性。
综上,该研究不仅提供了一个研究体内唾液酸化功能的实用工具小分子;而且,验证了唾液酸化抑制作为一种新型糖免疫检查点策略在治疗PDAC及其它免疫治疗耐受型肿瘤中的潜力;也表明Y-320具备良好的临床转化前景,有望为癌症免疫治疗提供新方案。
上述工作已以“A potent oral sialylation inhibitor augments the immunotherapy in pancreatic ductal adenocarcinoma” 为标题在ACS Central Science期刊发表。原文链接:https://pubs.acs.org/doi/10.1021/acscentsci.5c00939。
中国科学院上海有机化学研究所博士后牟珈慧为该研究的第一作者,上海药物所博士生陈润秋和有机所博士生代子豪为共同第一作者。中国科学院上海有机化学研究所俞飚院士为本研究的通讯作者,有机所王婧研究员、上海药物研究所宫丽崑研究员和龙益如博士为共同通讯作者。该工作还得到了上海科技大学白芳研究员、有机所房鹏飞研究员以及上海科技大学博士生杨皓、杭州高等研究院研究生索菲亚珊和李一藩等的支持。该工作得到了国家自然科学基金委、科技部、中国科学院等项目和基金的资助。
附件下载:

