

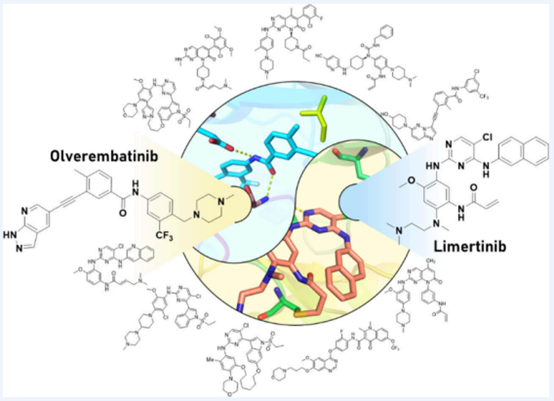
耐药性始终是激酶抑制剂治疗所面临的核心挑战。这些突变会改变激酶活性位点内的氨基酸残基,重塑局部化学环境,并破坏关键的药物-靶点相互作用。由此产生的变化——如空间位阻、关键氢键丢失、反应性残基消除或其他结构不相容性——会显著削弱药物疗效。为应对这些挑战,药物分子必须进行精准的化学适配:通过战略性结构修饰,使其分子特征(如几何形状、立体化学、酸碱性及反应性)与突变激酶结合口袋中因突变导致的空间、电子及反应性 landscape 变化相契合。基于此,生命过程小分子调控全国重点实验室丁克课题组在本文中(https://doi.org/10.1021/acs.accounts.5c00496)系统阐述如何运用化学适配原则指导合理设计小分子激酶抑制剂以克服临床耐药问题;并总结了过去 18 年间课题组基于此策略成功发现并推动两款靶向药物——奥雷巴替尼与利厄替尼——获批上市,并推进了多个临床阶段候选药物。
奥雷巴替尼用于治疗携带守门员 Bcr-AblT315I 突变的慢性髓系白血病患者,该突变会导致对第一、二代抑制剂耐药。为缓解空间冲突并恢复缺失的氢键作用,我们引入炔烃连接链以适配构象变化,并采用 1H-吡唑并[3,4-b]吡啶基团在铰链区形成新的稳定氢键。针对 EGFRT790M 驱动耐药的晚期肺癌患者,我们设计了带有亲电基团的杂环支架,可共价靶向 Cys797,从而实现对 EGFR 突变体的高选择性抑制,同时避免对野生型 EGFR 的影响。该策略最终促成第三代 EGFR 抑制剂利厄替尼的研发成功——这款兼具强效与突变选择性的药物已获批用于治疗伴或不伴 EGFRT790M 突变(包括脑转移)的患者。基于此成果,我们正持续推进新一代抑制剂研发,以克服包括 EGFRL858R/T790M/C797S 在内的复合耐药突变。
总之,本述评系统阐释了奥雷巴替尼与利厄替尼获批背后所依托的药物化学策略,揭示了如何通过化学适配理念突破激酶抑制剂耐药困境。未来,我们将把这一策略拓展至更广泛的药物模式与治疗靶点,以应对持续演进的临床挑战。
工作得到中国科技部重大研发计划、国家自然科学基金委和中国科学院先导项目等资助。
附件下载: