

近日,中国科学院上海有机化学研究所生物与化学交叉研究中心朱正江团队与生命过程小分子调控全国重点实验室陈以昀团队于Nature Chemistry发表题为“Quantitative profiling of lipid transport between organelles enabled by subcellular photocatalytic labeling” 的研究 (DOI:10.1038/s41557-025-01886-w)。研究融合双方优势(朱正江团队:代谢组与脂质组学;陈以昀团队:光催化邻近标记技术),攻克生理状态下亚细胞脂质动态监测的领域挑战。团队首创“亚细胞光催化叠氮邻近标记脂质组学技术”:通过高分辨质谱驱动的原位脂质组学分析,实现了线粒体、细胞核及溶酶体等关键细胞器的脂质组成解析;发展稳定同位素示踪-光催化邻近标记联用技术,完成了细胞器间脂质运输的精准定量表征。
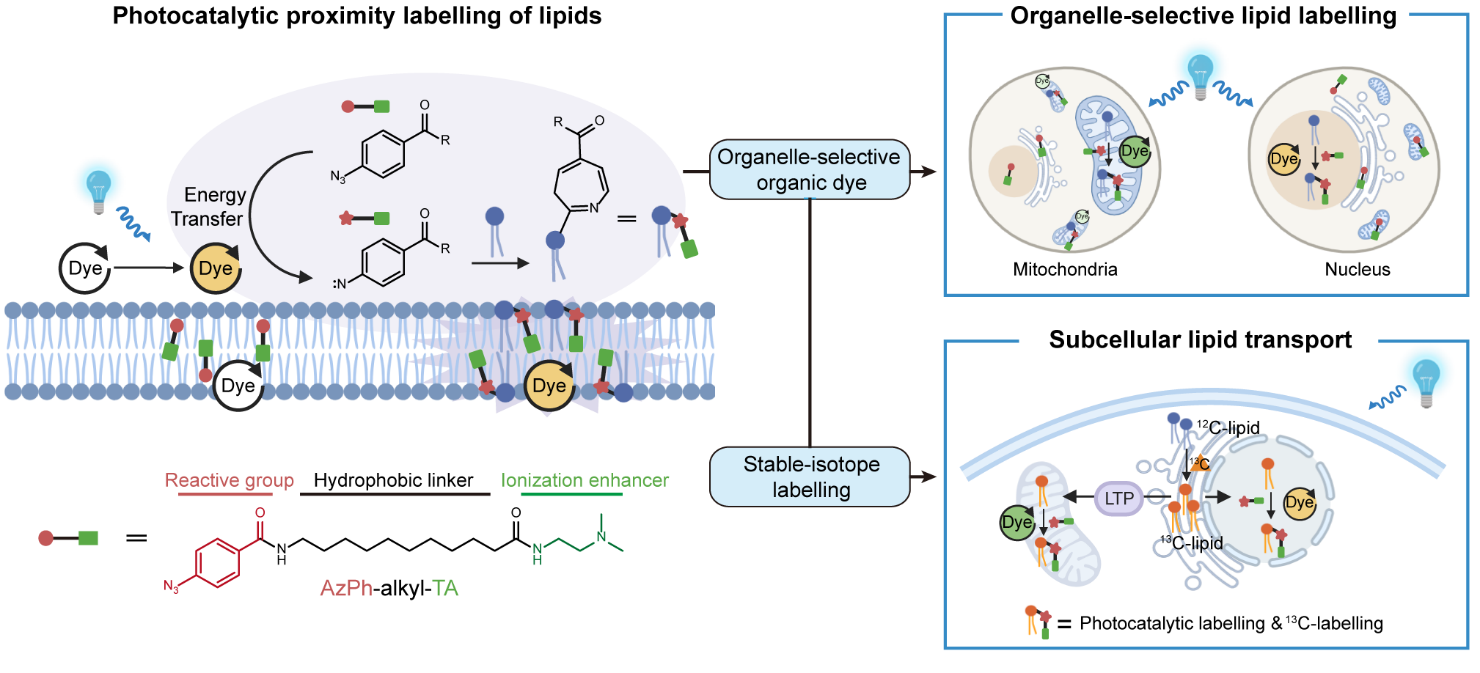
图1.亚细胞定位光催化邻近标记脂质组学技术
脂质作为生命活动的核心物质,在细胞功能中扮演多重关键角色,既是细胞膜的基本组成,提供疏水隔离环境与跨膜蛋白嵌入基质,又广泛参与信号转导及能量储存等生理过程,其功能实现与其在细胞内的空间分布密切相关。细胞内不同亚细胞结构通过独特的脂质组成,精准支持特定生化反应与功能需求。而脂质在细胞器间的有序转运,更是维持细胞结构稳定、能量代谢平衡及信号调控的核心环节。细胞器间脂质转运失调能导致多种人类重大疾病。如何在生理状态下对亚细胞脂质的分布特征、转运路径及代谢规律进行精准测量,已成为当前生命科学领域亟待突破的重要课题。
朱正江和陈以昀合作研究团队依据脂质化学结构特点,设计并合成了适用于脂质邻近标记的小分子探针;进一步以具有细胞器特异性定位的小分子荧光染料作为光催化剂,在可见光照射下激活并催化标记探针,使其与特定细胞器中含亲核基团(如氨基、羟基)的脂质分子反应,得到光催化标记脂质(Photocatalytically labelled lipids)。结合高分辨质谱驱动的脂质组学分析,该技术无需分离细胞器即可实现亚细胞定位脂质组的精准分析(图 1)。利用此技术,研究团队在线粒体、细胞核与溶酶体中分别鉴定出 60-80 种脂质,涵盖磷脂酰乙醇胺(PE)、烯醚磷脂酰乙醇胺(PE (P))、溶血磷脂酰乙醇胺(LPE)、溶血烯醚磷脂酰乙醇胺(LPE (P))、磷脂酰丝氨酸(PS)、鞘氨醇(Sph)及胆固醇(Chol)等七类脂质。免疫荧光共定位、传统细胞器分离及基因敲除等一系列生化实验,证实该邻近标记脂质组学技术具有较高的亚细胞定位特异性,为生理条件下解析亚细胞脂质空间分布提供了有力技术工具。
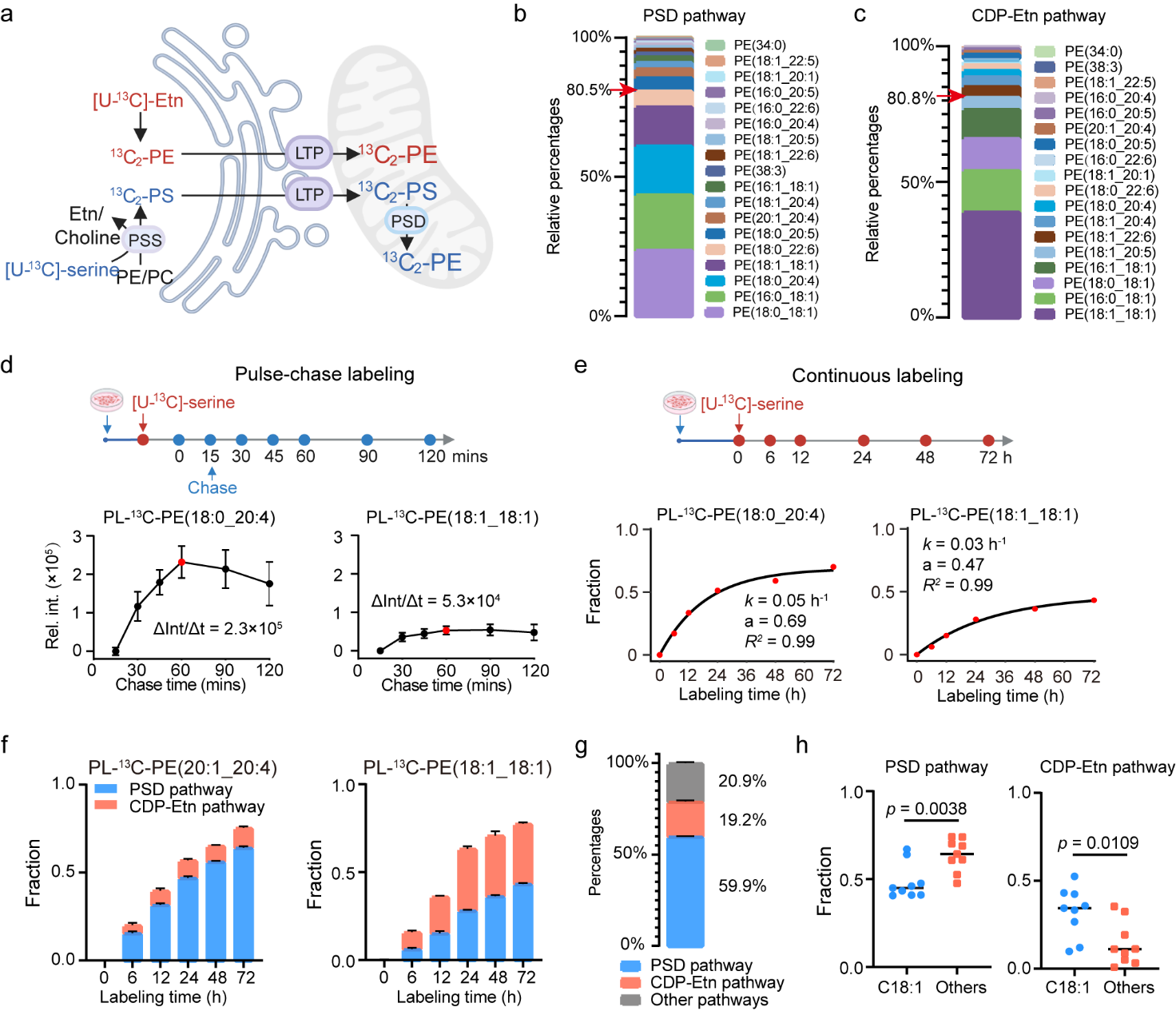
图2. 内质网到线粒体的脂质转运定量分析
细胞内常见脂质分子在内质网从头合成后,转运至线粒体、溶酶体等其他细胞器。为此,研究团队将亚细胞邻近标记脂质组学技术与稳定同位素示踪标记技术结合,发展出 “邻近标记 +¹³C-同位素” 双标记策略,系统定量表征了脂质分子从内质网到线粒体、溶酶体、细胞核等亚细胞器的转运规律(包括转运速率、周转等),并首次定量分析了各种脂质合成途径和运输途径对特定细胞器脂质组成的贡献比例(图 2)。具体而言,脉冲-追踪实验(Pulse-chase labeling)表明,磷脂酰丝氨酸(PS)由内质网向线粒体的转运在1小时内快速进行,且存在脂肪酰基链偏好性。而连续标记实验(Continuous labeling)通过检测多个时间点线粒体、细胞核、溶酶体中双标记磷脂酰乙醇胺脂质(PL-¹³C-PE lipids),并利用一阶速率方程定量分析了内质网内CDP-ethanolamine合成途径(the CDP-Etn pathway)与线粒体内磷脂酰丝氨酸脱羧酶合成途径(the PSD pathway)对多种细胞器内磷脂酰乙醇胺(PE)脂质的贡献。研究结果表明,线粒体中PE类脂质主要来源于 PSD合成途径,而细胞核与溶酶体中 PE 脂质主要来源于CDP-Etn合成途径。值得注意的是,线粒体中CDP-Etn合成途径偏向贡献含C18:1脂肪酰基链的 PE 类脂质,PSD合成途径则相反。进一步,该方法揭示脂质转运蛋白 VPS13A 和 PDZD8 在维持内质网与线粒体间脂质转运中起关键作用,且具有脂肪酰基链选择性。此外,该方法还发现,mTOR 激活可特异性提高溶酶体中胆固醇、PE类脂质 和 PS类脂质的含量,而不影响整个细胞内脂质含量,为细胞器介导的脂质代谢研究提供了有力技术支撑。
综上,该研究开发了新型的亚细胞定位光催化叠氮邻近标记脂质组学技术。该技术巧妙结合稳定同位素示踪与高分辨质谱组学分析,突破了传统方法的限制,无需分离细胞器,即可在活细胞中精准测定不同细胞器的脂质组成及细胞器间脂质转运等时空动态变化规律。基于此,本研究首次实现了对各类脂质合成与运输途径如何贡献于特定细胞器脂质组成的系统性定量解析,为深入探索亚细胞层次的脂质代谢规律及相关疾病机制提供了强大的技术支撑。
本研究论文的共同第一作者为中国科学院上海有机化学研究所博士后陈曦和该所与上海科技大学联合培养博士生贺茹。共同通讯作者为朱正江研究员和陈以昀研究员。论文的第一完成单位是中国科学院上海有机化学研究所。该研究得到了国家自然科学基金委、科技部、中国科学院、上海市科委等部门的经费支持。
Quantitative Profiling of Lipid Transport between Organelles Enabled by Subcellular Photocatalytic Labeling
Xi Chen†,Ru He†,Haolin Xiong,Ruohong Wang,Yandong Yin,Yiyun Chen*,and Zheng-Jiang Zhu*
Nat. Chem. 2025,doi:10.1038/s41557-025-01886-w
附件下载: