

细胞自噬(autophagy)是真核细胞内一种高度保守的分解代谢过程。细胞通过细胞自噬不仅可以回收利用各种基本的生命物质,同时也可以清除入侵病原体、受损线粒体等有害物质。因此,细胞自噬在众多的生理过程中扮演着重要角色。与此同时,众多的人类疾病均与细胞自噬的功能异常密切相关,比如癌症、神经退行性疾病等。在经典的巨自噬(macroautophagy)过程中,细胞通过吞噬泡(phagophore)的引发、延伸进而形成自噬体(autophagosome)来包裹细胞内待降解的自噬底物,比如糖原、蛋白聚集物、受损细胞器和入侵病原体等。在吞噬泡的引发和延伸阶段,WIPI2b蛋白招募并激活ATG12~ATG5-ATG16L1复合物,使其发挥类E3酶的活性,实现对ATG8家族蛋白的脂质化修饰,进而促进吞噬泡的延伸和自噬体的形成过程。然而,其中WIPI2b蛋白招募ATG16L1复合物——这一关键自噬步骤的具体分子机制仍不清楚。
近期,中科院上海有机化学研究所生命有机化学国家重点实验室的潘李锋研究组在《Science Advances》杂志发表了题为“ATG16L1 adopts a dual–binding site mode to interact with WIPI2b in autophagy”的研究论文(https://www.science.org/doi/10.1126/sciadv.adf0824)。在该项研究中,其团队成员综合运用等温滴定量热技术、快速蛋白液相色谱和多角度光散射等多种生化表征手段,首次发现除了已经报道的WIPI2b结合位点(WBS1)外,ATG16L1的卷曲螺旋结构域上还存在另一个全新的WIPI2b结合位点(WBS2)。进一步通过解析WIPI2b分别与ATG16L1的WBS1和WBS2的2个高分辨率的复合物晶体结构,该团队详细揭示了WIPI2b招募ATG16L1复合物的分子机制和参与招募的关键氨基酸残基。有趣的是,尽管ATG16L1的WBS1和WBS2竞争结合WIPI2b的同一个口袋,但是根据结构建模的结果,ATG16L1与WIPI2b能以2:4的化学剂量比形成复合物。值得注意的是,ATG16L1的WBS1位点只存在于哺乳动物中,而WBS2在酵母和哺乳动物中都很保守。为了进一步明确WBS2位点的自噬功能,该团队利用CRISPR-Cas9系统在HeLa细胞系中成功敲除了ATG16L1基因,并设计回补了ATG16L1突变体D164R(破坏WBS2位点)、L224Q(破坏WBS1微单)、DRLQ(同时破坏WBS1和WBS2位点)和野生型的ATG16L1。后续通过检测p62的降解程度以及LC3B的脂质化修饰程度,该团队发现ATG16L1的WBS2位点对于自噬的正常进行是不可或缺的,而ATG16L1的WBS1位点则起到进一步促进自噬流的作用。总之,本项研究工作对核心自噬蛋白WIPI2b和ATG16L1之间的相互作用进行了详尽的生化和结构表征,首次揭示了ATG16L1以双结合位点模式结合WIPI2b的分子机制,并通过相关的细胞功能实验验证了ATG16L1和WIPI2b的双位点结合模式在经典自噬过程中的重要作用,为进一步理解巨自噬过程的分子机制奠定了基础。
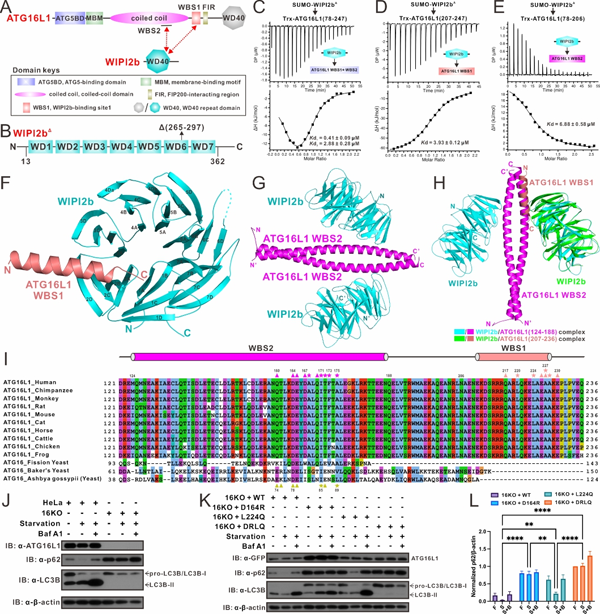
图1. WIPI2b结合ATG16L1的分子机制
潘李锋课题组已毕业的博士生龚新宇为本文的第一作者。上述研究工作得到国家自然科学基金委、科技部、上海市科委、中科院和生命有机化学国家重点实验室的资助。
附件下载: