

细胞自噬是一种在真核细胞中高度受调控的、溶酶体依赖性的重要细胞代谢过程,主要参与降解细胞内的大型蛋白聚集体、衰老损伤的细胞器以及侵入细胞的病原体等。它的功能异常与多种神经退行性疾病的发生密切相关,比如,大脑神经细胞内多聚谷氨酰胺(PolyQ)蛋白聚集体的异常降解会导致亨廷顿舞蹈症(Huntington’s Disease), 而功能受损的线粒体的异常降解被认为与帕金森症(Parkinson’s disease)的发生高度相关。
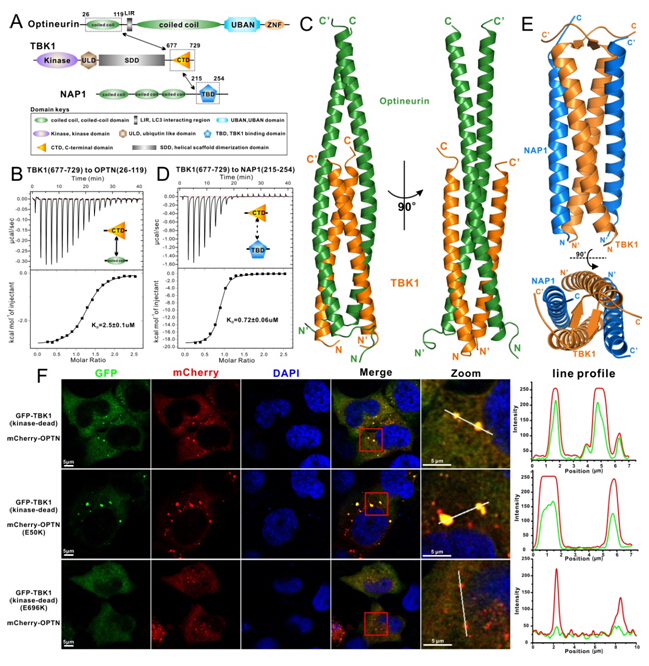
Optineurin(OPTN) 是一个多功能的自噬受体蛋白,在细胞选择性自噬的底物识别环节发挥着重要的作用,被报道参与选择性自噬降解细胞内衰老损伤的线粒体,毒性的蛋白聚集体以及入侵细胞的病原体,它的基因突变导致的功能异常与诸多神经退行性疾病的发生密切相关,如原发性开角型青光眼(POAG)和肌萎缩侧索硬化症(ALS)。同时,近期的遗传学研究表明:蛋白激酶TBK1的多种缺失体和点突变体与神经退行性疾病ALS的发生有关,尤其是位于与OPTN相互作用的C末端区域的TBK1 E696K突变体和690-713缺失体。此外,在Parkin介导的降解线粒体的选择性自噬(mitophagy)过程中,TBK1能够与自噬受体蛋白OPTN相互作用,进而磷酸化OPTN的LIR区域和UBAN结构域,从而参与调控相关的选择性细胞自噬过程。但是,迄今为止,关于OPTN蛋白与TBK1相互作用的结构基础、以及与POAG和ALS疾病相关的基因突变的致病机制仍然未知。近期,中科院上海有机化学研究所生命有机化学国家重点实验室潘李锋研究组在国际期刊《Nature Communications》发表了题为“Structural insights into the interactionand disease mechanism of neurodegenerativedisease-associated optineurin and TBK1 proteins”的研究论文(Nature Communications, 2016, DOI:http://www.nature.com/articles/ncomms12708)。
该团队首先运用一系列的生化手段得到OPTN与TBK1发生相互作用的最小结合片段,然后运用X射线晶体衍射分析技术成功解析了OPTN与TBK1的复合物结构以及相关的TBK1与NAP1的复合物结构。这些解析的复合物结构不仅首次阐述了蛋白激酶TBK1与OPTN和NAP1相互作用的分子机制,揭示了一种TBK1识别不同脚手架蛋白的通用结合模式,而且从结构水平解释了POAG相关的OPTN E50K突变体和与ALS相关联的TBK1 E696K突变体的致病机制。此外,通过一系列的生物化学和细胞生物学实验发现:OPTN 的E50K突变不仅能增强与TBK1的相互作用,而且还能改变OPTN在细胞内的聚集状态;并且在细胞内,TBK1 E696K点突变能特异性地打破TBK1与OPTN的相互作用,但并不显著影响TBK1与其它受体蛋白的相互作用。此项研究为进一步理解和阐明自噬受体蛋白OPTN的作用机制,蛋白激酶TBK1参与调节OPTN介导的选择性细胞自噬分子机制以及TBK1和OPTN相关的基因突变引起神经退行性疾病的致病机理提供了重要的结构基础。
潘李锋课题组的博士生李发祥为本文的第一作者,上述研究工作得到国家青年千人计划项目、科技部国家重点研发专项项目、科技部973计划青年专题项目、国家自然科学基金委面上项目、上海市启明星项目、生命有机化学国家重点实验室及中国科学院的资助。
附件下载: