

上海有机所发展微型光酶实现可见光精准调控细胞器功能
近日,中国科学院上海有机化学研究所生命过程小分子调控全国重点实验室陈以昀研究员团队在生物正交光调控研究领域取得重要进展。团队构建了仅12 kDa的微型光酶miniSOG可见光调控平台,成功实现活细胞内细胞器特异性的可见光精准时空调控。该技术通过原创的“生物正交可见光脱硼羟基化反应”,在亚细胞尺度上精准操控线粒体膜电位与细胞核表观遗传修饰,突破传统光调控技术背景干扰大、操作复杂和细胞功能扰动等瓶颈。相关成果发表于《德国应用化学》并被编辑部遴选为Hot Paper(Angew. Chem. Int. Ed. 2025, doi: 10.1002/anie.202515137)。
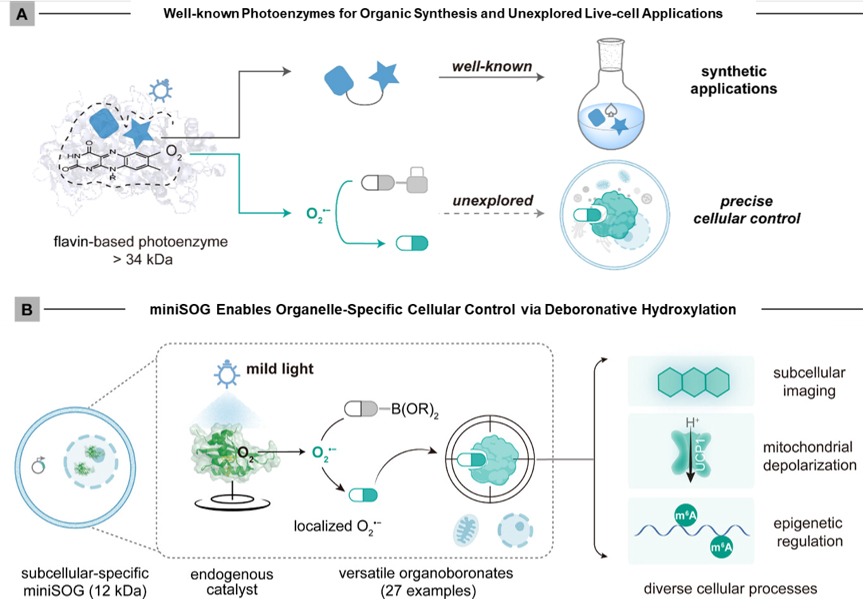
图1:miniSOG介导生物正交光催化实现细胞器靶向调控示意图
从“化学合成”到“生命调控”:光酶的范式革新
人工光酶在有机合成中应用广泛,但其生物应用面临三大挑战:分子尺寸限制亚细胞定位、氧敏感性高、生物相容性不足。陈以昀团队基于前期在生物正交光催化领域的系统性工作(小分子染料催化剂:Angew. Chem. Int. Ed. 2019; JACS Au 2021; Nat. Chem. 2025;杂合蛋白催化剂: Angew. Chem. Int. Ed. 2022; ACS Cent. Sci. 2024),创新发展黄素蛋白改造的基因编码微型光酶,实现“化学工具酶”向“生命调控器”的跨越,相关专利技术已布局。
三大技术突破开启精准光调控新时代
研究筛选获得的miniSOG光酶在蓝光激发下产生超氧阴离子自由基(O2•⁻),驱动生物正交脱硼羟基化反应,展现核心优势:一是广谱底物兼容:激活27类硼酸酯“笼蔽”分子,涵盖荧光探针、抗癌前药、表观遗传调节剂等生物功能分子;二是亚细胞级精度:融合亚细胞定位信号后,反应被严格限制在目标细胞器(如线粒体或细胞核,<0.2 μm扩散半径)三是活体友好设计:遗传编码特性消除外源背景,免洗操作下信噪比提升12倍,细胞存活率>94%且无应激响应。
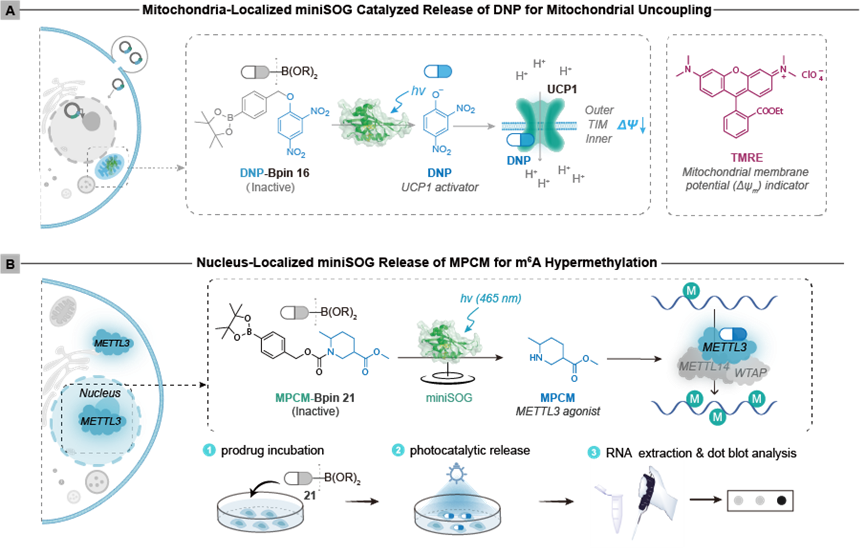
图2:线粒体膜电位调控(A)与细胞核m6A甲基化调控(B)示意图
细胞器功能精准调控实证
展望:为生命科学研究安装“光控开关”
该微型光酶平台将生物正交反应的精准可控性与酶的遗传编码特性结合,实现活细胞生命活动的高时空分辨光控,为基础生物学研究提供全新工具,为疾病机制研究与精准医疗提供新范式。
该工作由上海有机所与上海科技大学联培博士生车巧玲、贺茹及张祎昕副研究员共同完成,陈以昀研究员为通讯作者。研究得到了国家自然科学基金、中国科学院先导专项、中科院青年创新促进会及上海市科委等项目的资助。
论文信息:
Miniature Photoenzyme Enables Organelle-Specific Cellular Control via Deboronative Hydroxylation. Angew. Chem. Int. Ed.2025. doi: 10.1002/anie.202515137.
Qiaoling Che #, Ru He #, Yixin Zhang #, Haipeng Zhang, Kaixing Zeng, and Yiyun Chen*

附件下载:

