

上海有机所交叉中心发现氧化型左旋核酸作为ZBP1的新型配体驱动阿尔茨海默病神经炎症
阿尔茨海默病(AD)是一种尚未被攻克的神经退行性疾病,以Aβ斑块和tau神经纤维缠结为主要病理特征。随着我国老龄化加剧,AD患病率持续上升,给社会和家庭带来沉重经济负担。目前AD治疗药物研发进展缓慢。
近年研究发现,小胶质细胞介导的神经炎症在AD发生发展中起重要作用。小胶质细胞在AD中被Aβ过度持续激活,引发慢性炎症,加剧tau病理、星形胶质细胞活化及神经元损伤死亡。I型干扰素、TLR信号通路、NLRP3炎症小体等信号通路被发现参与驱动这一过程,但它们之间的功能联系尚不明确。
左旋核酸Z-DNA是一种非经典DNA结构,可通过先天免疫受体ZBP1激活免疫反应,在抗病毒及炎症调控中发挥关键作用。左旋核酸配体的鉴定成为领域内的核心科学问题。此外,早在30年前,研究就发现AD患者大脑中存在Z-DNA,但其形成机制、病理功能及ZBP1介导的识别机制的作用仍完全未知。
2025年9月2日,中国科学院上海有机化学研究所生物与化学交叉研究中心许代超研究团队在Immunity杂志在线发表了题为 "Innate immune sensing of Z-nucleic acids by ZBP1-RIPK1 axis drives neuroinflammation in Alzheimer's disease" 的研究论文,揭示了氧化断裂的Z型线粒体DNA(Z-mtDNA)可作为ZBP1的新型内源性配体,并驱动小胶质细胞介导的神经炎症过程。这一发现为理解左旋核酸感知以及AD神经免疫调控机制提供了全新视角。

研究团队发现,在AD病理环境下,氧化应激导致线粒体DNA(mtDNA)的鸟嘌呤发生氧化形成8-oxoG,随后DNA断裂,通过mPTP-VDAC通道释放至细胞质中。这些断裂的富含8-oxoG的mtDNA可发生构象转变,形成非经典的左旋Z型结构(Z-DNA)。这类氧化型Z-DNA可被ZBP1特异性识别,进而通过招募RIPK1并激活其激酶活性,同时促进I型干扰素、TLR信号和NLRP3炎症小体等多条促炎通路(图1),最终导致神经炎症和AD相关病理变化。
研究进一步在AD模型中发现,敲除ZBP1或抑制RIPK1活性可显著缓解神经炎症、Aβ沉积和行为缺陷。这一结果不仅确立了Z-DNA–ZBP1–RIPK1轴在AD神经炎症中的核心作用,也首次阐明氧化应激产生的内源性Z-DNA是激活该通路的关键分子。
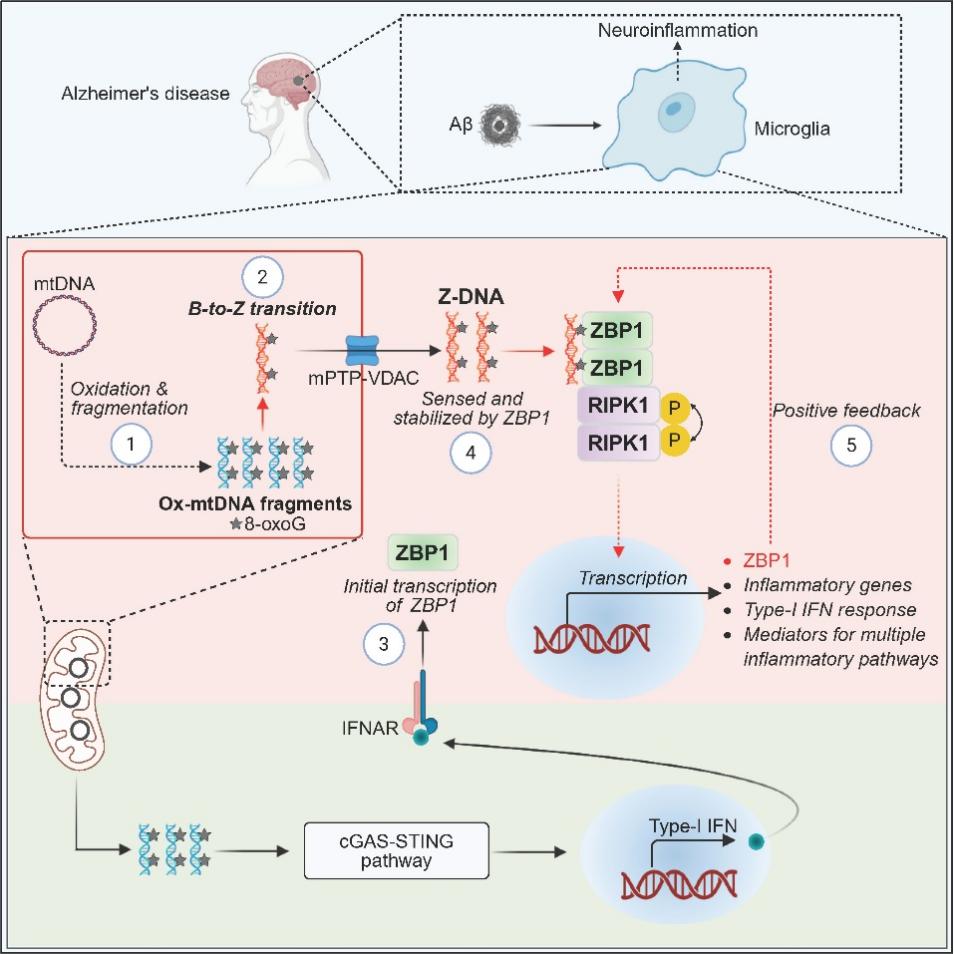
图1. 新型氧化型左旋核酸的产生及其在AD神经炎症中的的作用机制模型
总而言之,该研究于鉴定出氧化型左旋核酸作为ZBP1的新型配体,突破了以往认为ZBP1主要识别外源病原体核酸或未修饰内源核酸的认知,同时为AD的免疫机制提供了新视角。由于氧化应激广泛存在于多种人类疾病当中,该发现也对氧化应激相关的其他人类疾病的机制研究与治疗策略具有重要启示。目前RIPK1抑制剂已处于临床试验阶段,本研究为其应用于AD治疗提供了理论依据,未来或可与Aβ靶向治疗联合应用,为AD患者带来新的治疗希望。
中国科学院生物与化学交叉研究中心许代超研究员为本文通讯作者,浙江大学良渚实验室莫玮教授和苏州大学张健副教授为本文共同通讯作者;中国科学院生物与化学交叉研究中心博士生宋子雯为第一作者,博士后解醒醒和博士生陈宇璐为共同第一作者。该研究获得了科技部“科技创新-2030脑科学”重大研究计划,基金委青年基金(A类)、重大研究计划,上海市“尚思探索学者”、科技先行区、市级重大专项,以及中国科学院相关计划等项目的支持。
原文链接:https://doi.org/10.1016/j.immuni.2025.07.024
附件下载:

